
PUMPA - SMART LEARNING
எங்கள் ஆசிரியர்களுடன் 1-ஆன்-1 ஆலோசனை நேரத்தைப் பெறுங்கள். டாப்பர் ஆவதற்கு நாங்கள் பயிற்சி அளிப்போம்
Book Free Demoஎலக்ட்ரான்கள் ஆர்பிட் எனப்படும் வட்டப்பாதைகளில் உட்கருவைச் சுற்றி வருகின்றன என்பதை நீங்கள் அறிவீர்கள். அணுக்களின் உள்ள இந்த ஆர்பிட்டுகளில் எலக்ட்ரான்கள் பகிர்ந்து நிரப்பப்படுவது, குறிப்பிட்ட விதிகள் (அல்லது) நிபந்தனைகளுக்குட்பட்டே நடக்கிறது. இவ்விதிகள் எலக்ட்ரான் அமைப்புக்கான போர் மற்றும் புரி விதிகள் என்று அழைக்கப்படுகிறது.
அணுவின் கூடுகளில் எலக்ட்ரான்
பங்கீட்டுக்கான விதிகளை போர் மற்றும் புரி பின்வருமாறு முன் மொழிந்தனர்:-

போர் மற்றும் புரி மாதிரி
விதி (1): ஒரு வட்டப்பாதையில் இடம்பெரும் அதிகபட்ச எலக்ட்ரான்களின் எண்ணிக்கை
\(2n^2\) என்ற வாய்ப்பாட்டால் கணக்கிடப்படுகிறது. \(n\) என்பது முதன்மை குவாண்டம் எண் ஆகும்.
(அதாவது உட்கருவிலிருந்து கூட்டின் வரிசை
எண்)
ஆர்பிட் | n ன்
எண்ணிக்கை | எலக்ட்ரான்
எண்ணிக்கை \(2n^2\) |
K | 1 | \(2\) × \(1^2\) = \(2\) |
L | 2 | \(2\) × \(2^2\) = \(8\) |
M | 3 | \(2\) × \(3^2\) = \(18\) |
N | 4 | \(2\) × \(4^2\) = \(32\) |
விதி (2): கூடுகள் அவற்றின் ஆற்றல்களின் ஏறு வரிசையில் எலக்ட்ரான்களால் படிப்படியாக
நிரப்பப்படுகின்றன.
விதி (3): வெளிவட்டப் பாதையில் உள்ள எலக்ட்ரான்களின் எண்ணிக்கை \(8\) க்கு
மிகாமலும், அதற்கு முந்தைய வட்டப்பாதையில் \(18\) க்கு மிகாமலும் இருக்கும்.
விளக்கம்:
அலுமினியம் அணுவின் அமைப்பு (\(13\)
எலட்ரான்கள்) முறையே (\(2, 8, 3\))
K - ஆர்பிட் = \(2\) எலக்ட்ரான்கள்
L - ஆர்பிட் = \(8\) எலக்ட்ரான்கள்
M - ஆர்பிட் = \(3\) எலக்ட்ரான்கள்
எனவே, அலுமினியத்தின் எலக்ட்ரான் அமைப்பு (\(2, 8, 3\))
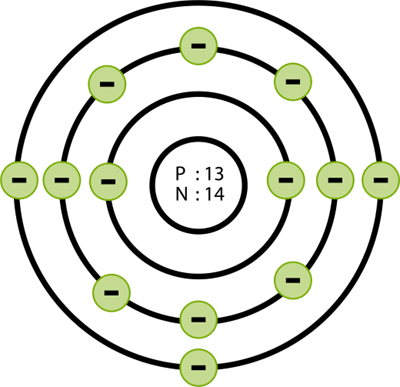
அலுமினியத்தின் எலக்ட்ரான் அமைப்பு