
PUMPA - SMART LEARNING
எங்கள் ஆசிரியர்களுடன் 1-ஆன்-1 ஆலோசனை நேரத்தைப் பெறுங்கள். டாப்பர் ஆவதற்கு நாங்கள் பயிற்சி அளிப்போம்
Book Free Demoஒரு அணுவில் உள்ள எலக்ட்ரான்கள் அணுக்கருவைச் சுற்றி கூடுகளில் அமைக்கப்பட்டிருப்பதை நாம் ஏற்கனவே அறிவோம்.
ஒவ்வொரு கூடும் ஒன்று அல்லது அதற்கு மேற்பட்ட துணைக் கூடுகளைக் கொண்டுள்ளது, அதில் எலக்ட்ரான்கள் ஒரு குறிப்பிட்ட முறையில் நிரப்பப்படுகின்றன. இந்த துணைக் கூடுகளைக் \(s\), \(p\), \(d\) மற்றும் \(f\) என பெயரிடப்பட்டுள்ளது.
துணைக்கூடுகளில் எலக்ட்ரான்கள் வைக்கப்பட்டுள்ள அமைப்பின் அடிப்படையில் தனிமங்களை \(s\), \(p\), \(d\) மற்றும் \(f\) என நான்கு துணைத் தொகுதிகளாகப் பிரிக்கப்பட்டுள்ளன.
ஒவ்வொரு கூடும் ஒன்று அல்லது அதற்கு மேற்பட்ட துணைக் கூடுகளைக் கொண்டுள்ளது, அதில் எலக்ட்ரான்கள் ஒரு குறிப்பிட்ட முறையில் நிரப்பப்படுகின்றன. இந்த துணைக் கூடுகளைக் \(s\), \(p\), \(d\) மற்றும் \(f\) என பெயரிடப்பட்டுள்ளது.
துணைக்கூடுகளில் எலக்ட்ரான்கள் வைக்கப்பட்டுள்ள அமைப்பின் அடிப்படையில் தனிமங்களை \(s\), \(p\), \(d\) மற்றும் \(f\) என நான்கு துணைத் தொகுதிகளாகப் பிரிக்கப்பட்டுள்ளன.
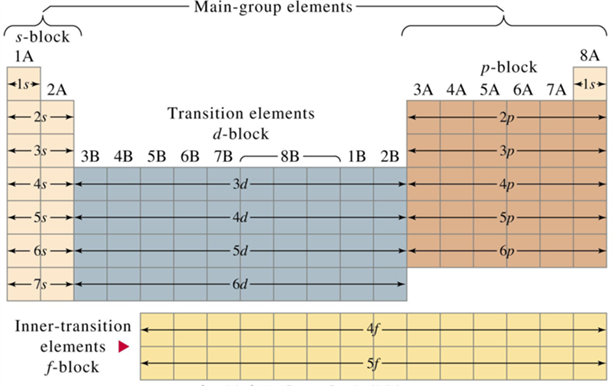
\(s\), \(p\), \(d\) மற்றும் \(f\) தொகுதி தனிமங்கள்
s - தொகுதி தனிமங்கள்:
i. கார உலோகங்கள்.
இது தொகுதி \(1\) (கார உலோகங்கள்) மற்றும் தொகுதி \(2\) (கார மண் உலோகங்கள்) இல் உள்ள தனிமங்களை வரிசைப்படுத்தும் போது கடைசி எலக்ட்ரானானது \(s\) துணைக் கூட்டில் வைக்கப்படுகிறது. எனவே இந்த தனிமங்கள் s-தொகுதி தனிமங்கள் என்று அழைக்கப்படுகின்றன. ஹைட்ரஜனை தவிர இத்தொகுதியில் உள்ள தனிமங்கள் உலோகங்களாகும். இவை நீருடன் வினைபுரிந்து உருவாக்கும் கரைசலானது சிவப்பு லிட்மஸ் காகிதத்தை நீல நிறமாக மாற்றும். இந்தக் கரைசல்கள் அதிககாரத்தன்மை கொண்டதாகக் காணப்படுகின்றன. எனவே, இவை கார உலோகங்கள் என்று அழைக்கப்படுகின்றன.
ii. கார மண் உலோகங்கள்.
தொகுதி \(2\) இன் தனிமங்களும் உலோகங்களே. இவை ஆக்ஸிஜனோடு இணைந்து ஆக்ஸைடுகளை உருவாக்குகின்றன. முன்பு இவை 'புவி (அ) மண் ' என்று அழைக்கப்பட்டன. இந்த ஆக்ஸைடுகள் நீரில் கரையும் போது கார கரைசல்களை உருவாக்குகின்றன. எனவே, இவை கார மண் உலோகங்கள் என்றும் அழைக்கப்படுகின்றன.